Asam dan basa
sudah dikenal sejak zaman dulu. Istilah asam (acid) berasal dari bahasa Latin
acetum yang berarti cuka. Istilah basa (alkali) berasal dari bahasa Arab yang
berarti abu. Basa digunakan dalam pembuatan sabun. Juga sudah lama diketahui
bahwa asam dan basa saling menetralkan. Di alam, asam ditemukan dalam
buah-buahan, misalnya asam sitrat dalam buah jeruk berfungsi untuk memberi rasa
limun yang tajam. Cuka mengandung asam asetat, dan asam tanak dari kulit pohon
digunakan untuk menyamak kulit. Asam mineral yang lebih kuat telah dibuat sejak
abad pertengahan, salah satunya adalah aqua forti (asam nitrat) yang digunakan
oleh para peneliti untuk memisahkan emas dan perak.
1. Teori asam dan basa
Arrhenius
Pada tahun 1884, Svante Arrhenius (1859-1897) seorang ilmuwan Swedia yang
memenangkan hadiah nobel atas karyanya di bidang ionisasi, memperkenalkan
pemikiran tentang senyawa yang terpisah atau terurai menjadi bagian ion-ion
dalam larutan. Dia menjelaskan bagaimana kekuatan asam
dalam larutan aqua (air) tergantung pada konsentrai ion-ion hidrogen di
dalamnya.
Menurut Arrhenius, asam
adalah zat yang dalam air melepakan ion H+, sedangkan basa
adalah zat yang dalam air melepaskan ion OH-. Jadi pembawa sifat asam adalah ion H+,
sedangkan pembawa sifat basa adalah ion OH-. Asam
Arrhenius dirumuskan sebagai HxZ, yang dalam air mengalami ionisasi sebagai
berikut.
HxZ
⎯⎯→ xH+ + Zx–
Jumlah ion H+
yang dapat dihasilkan oleh 1 molekul asam disebut valensi asam,
sedangkan ion negatif yang terbentuk dari asam setelah melepaskan ion H+
disebut ion sisa asam. Beberapa contoh
asam dapat dilihat pada tabel 5.1.
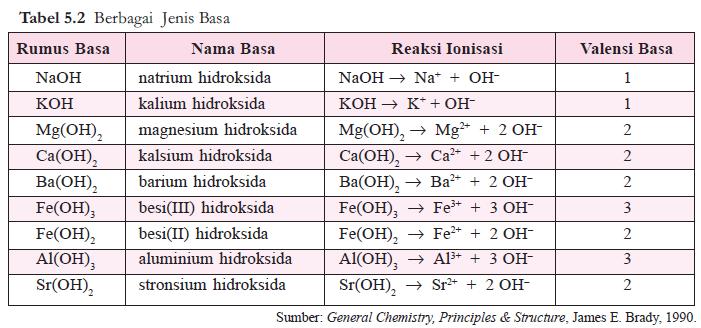
Basa Arrhenius adalah hidroksida
logam, M(OH)x, yang dalam air terurai sebagai berikut.
M(OH)x
⎯⎯→ Mx+ + x OH–
Jumlah ion OH–
yang dapat dilepaskan oleh satu molekul basa disebut valensi basa. Beberapa
contoh basa diberikan pada tabel 5.2.
Asam sulfat dan magnesium
hidroksida dalam air mengion sebagai berikut.
H2SO4 ⎯⎯→ 2 H+ + SO42–
Mg(OH)2 ⎯⎯→ Mg+ + 2 OH–
Mg(OH)2 ⎯⎯→ Mg+ + 2 OH–
2. Teori Asam-Basa Bronsted dan Lowry
- Menurut Bronsted dan Lowry, asam adalah spesi yang memberi proton, sedangkan basa adalah spesi yang menerima proton pada suatu reaksi pemindahan proton.

- Perhatikan contoh berikut.
NH4
+ (aq) + H2O(l) ⎯→
NH3(aq) + H3O+(aq)
asam
basa
H2O(l)
+ NH3(aq) ⎯⎯→
NH4+(aq) + OH–(aq)
asam
basa
- Pada contoh di atas terlihat bahwa air dapat bersifat sebagai asam (donor proton) dan sebagai basa (akseptor proton).
- Zat seperti itu bersifat amfiprotik (amfoter).
- Konsep asam-basa dari Bronsted-Lowry ini lebih luas daripada konsep asam-basa Arrhenius karena hal-hal berikut :
- Konsep asam-basa Bronsted-Lowry tidak terbatas dalam pelarut air, tetapi juga menjelaskan reaksi asam-basa dalam pelarut lain atau bahkan reaksi tanpa pelarut.
- Asam-basa Bronsted-Lowry tidak hanya berupa molekul, tetapi juga dapat berupa kation atau anion. Konsep asam-basa ronsted-Lowry dapat menjelaskan sifat asam dari NH4Cl. Dalam NH4Cl, yang bersifat asam adalah ion NH4+ karena dalam air dapat melepas proton.
Asam
dan Basa Konjugasi
- Suatu asam setelah melepas satu proton akan membentuk spesi yang disebut basa konjugasi dari asam tersebut.
- Sedangkan basa yang telah menerima proton menjadi asam konjugasi.
- Perhatikan tabel berikut.
- Pasangan asam-basa setelah terjadi serah-terima proton dinamakan asam-basa konjugasi.
3.Teori Asam-Basa LEWIS
- Teori asam basa Lewis
Asam
menurut Lewis adalah zat yang dapat menerima pasangan electron (akseptor
pasangan electron)
Basa
menurut Lewis adalah zat yang dapat memberikan pasangan electron (donor
pasangan electron).
Lewis
mengamati bahwa molekul BF3 juga dapat berperilaku seperti halnya
asam (H+) sewaktu bereaksi dengan NH3. Molekul BF3 dapat
menerima sepasang elektron dari molekul NH3 untuk membentuk ikatan
kovalen antara B dan H.
Teori
asam basa Lewis lebih luas dibandingkan Arhenius dan Bronsted Lowry , karena :
- Teori Lewis dapat menjelaskan reaksi asam basa yang berlangsung dalam pelarut air, pelarut bukan air, dan tanpa pelarut sama sekali.
- Teori Lewis dapat menjelaskan reaksi asam basa yang tidak melibatkan transfer proton (H+), seperti reaksi antara BF3 dan NH3.
Keuntungan
utama teori asam basa Lewis terletak pada fakta bahwa beberapa reaksi yang
tidak dianggap sebagai reaksi asam basa dalam kerangka teori Arrhenius dan
Bronsted Lowry terbukti sebagai reaksi asam basa dalam teori Lewis. Sebagai
contoh reakasi antara boron trifluorida BF3 dan ion fluorida F-.
BF3
+ F-–> BF4-
Reaksi
ini melibatkan koordinasi boron trifluorida pada pasangan elektron bebas ion
fluorida. Menurut teori asam basa Lewis, BF3 adalah asam. Untuk
membedakan asam semacam BF3 dari asam protik (yang melepas proton,
dengan kata lain, asam dalam kerangka teori Arrhenius dan Bronsted Lowry), asam
ini disebut dengan asam Lewis. Boron membentuk senyawa yang tidak memenuhi
aturan oktet, dan dengan demikian adalah contoh khas unsur yang membentuk asam
Lewis.
Karena
semua basa Bonsted Lowry mendonasikan pasangan elektronnya pada proton, basa
ini juga merupakan basa Lewis. Namun, tidak semua asam Lewis adalah asam
Bronsted Lowry sebagaimana dinyatakan dalam contoh di atas.
Dari
ketiga definisi asam basa di atas, definisi Arrhenius yang paling terbatas.
Teori Lewis meliputi asam basa yang paling luas. Sepanjang yang dibahas adalah
reaksi di larutan dalam air, teori Bronsted Lowry paling mudah digunakan,
tetapi teori Lewis lah yang paling tepat bila reaksi asam basa melibatkan
senyawa tanpa proton.
Pertanyaan:
|
HCl + H2O
→ Cl- + H3O+
| |||||||



menanggapi pertanyaan admin tentang mengapa pada reaksi tersebut air dapat bertindak sebagai basa. menurut tanggapan saya hal ini karena air bersifat amfoter yaitu dapat bertindak sebagai asam maupun basa. jika bereaksi dengan asam maka air akan bertindak sebagai basa.
BalasHapusmenanggapi pertanyaan postingan admin tentang mengapa pada reaksi tersebut air dapat bertindak sebagai basa. jika menurut saya
BalasHapusAsam bereaksi dengan air dengan mendonorkan ion H+ pada molekul air yang netral untuk membentuk ion H3O+.
HCl(g) + H2O(l) → H3O+(aq) + Cl–(aq)
asam basa
Karena reaksi asam basa merupakan reaksi yang reversibel, bagian yang terbentuk ketika suatu asam kehilangan proton cenderung bersifat basa, dan bagian yang menerima proton cenderung bersifat asam. Sebuah asam dan sebuah basa yang dihubungkan oleh sebuah proton disebut pasangan asam basa konjugasi.
HCl + H2O → Cl- + H3O+
BalasHapusmenanggapi pertanyaan admin tentang mengapa pada reaksi tersebut air dapat bertindak sebagai basa. menurut tanggapan saya hal ini karena menurut bronsted lowry bahwa Pasangan asam-basa setelah terjadi serah-terima proton dinamakan asam-basa konjugasi dimana Hcl melepaskan electron H nya